
新闻资讯
2022年8月9日,上海天泽云泰生物医药有限公司(以下简称“天泽云泰”)宣布其自主研发的VGR-R01注射剂(rAAV2/8-CYP4V2)新药临床试验(IND)申请获得国家药品监督管理局药品审评中心(CDE)受理。VGR-R01是天泽云泰自主研发的针对CYP4V2基因突变导致的结晶样视网膜变性(Bietti crystalline dystrophy, BCD)患者的基因治疗产品,也是全球范围内首个申请新药临床试验的针对BCD的治疗性药物,作用原理为基因替代。

图1. VGR-R01注射剂IND申请获受理
“BCD是相对高发于中国但在西方国家少见的遗传性视网膜疾病。”天泽云泰科学创始人李伟研究员表示,“有鉴于此,对于BCD这个很少受关注的罕见病,我们更有为中国患者做药的使命感。自与首都医科大学附属北京同仁医院魏文斌教授团队携手合作的四年来,我们在BCD的临床前研究不断累积,也夯实了向临床转化的基础。对于BCD患者而言,VGR-R01申报IND是一个重要里程碑;对我们医药行业从业者来讲,也是令人欣慰的一个重要时刻,期待利用基因疗法为更多患者带来治愈的机会。”
关于结晶样视网膜变性
结晶样视网膜变性(Bietti crystalline dystrophy, BCD)又称Bietti结晶样视网膜病变,是一种常染色体隐性遗传的进展性视网膜变性疾病。BCD突变基因是位于4q35的CYP4V2,编码一种与脂肪代谢相关的蛋白酶,因纯合子或复合杂合子突变致病。大多数BCD患者于20-40岁发病,出现夜盲和视力下降等症状,在50-60岁发展为法定盲人。虽然是一类危害严重的致盲性遗传眼病,但与一些广受关注的“明星遗传病”相比,针对BCD的基础和临床研究都较为匮乏。在Bietti教授首次临床观察到并为这种疾病命名的八十年后的今天,BCD依然无药可治。
关于VGR-R01
VGR-R01是针对CYP4V2基因突变导致的BCD患者的基因治疗产品。CYP4V2蛋白为P450酶家族成员,在视网膜色素上皮细胞(retinal pigment epithelium,RPE)中高度表达,具有脂肪酸羟化酶活性,与脂肪代谢相关。VGR-R01的作用原理是一种基因替代疗法,通过回补正确拷贝的CYP4V2基因,介导RPE细胞表达CYP4V2蛋白。VGR-R01通过纠正患者视网膜内的脂肪酸代谢障碍,以期达到预防或改善RPE细胞、感光细胞及脉络膜的结构和/或功能损伤,并实现纠正视力损伤、保护残存视功能、或延缓视力恶化的临床效果。
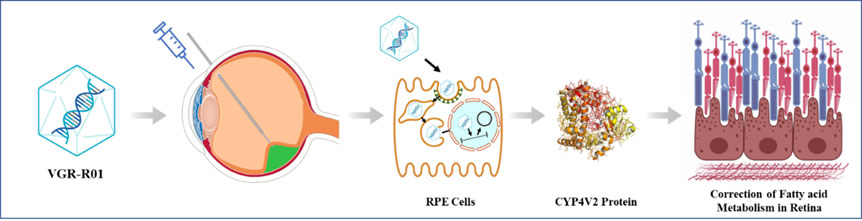
图2. VGR-R01作用机制图示
VGR-R01的早期临床研究
首都医科大学附属北京同仁医院正在开展“VGR-R01治疗结晶样视网膜色素变性(BCD)的早期临床研究”。本研究已通过北京同仁医院临床试验伦理委员会批准(伦理批件号:
TREC2022-KY010)。
主要研究者
魏文斌教授、赵秀丽教授
联系人
张老师 13552757069、王医生(微信13683178767)
主要入组标准
1.年龄≥18周岁,<80周岁,性别不限;
2.临床确诊为BCD疾病,且分子诊断证实CYP4V2双等位基因突变;
3.目标眼的******矫正视力≤0.1;
4.须同意使用可靠的避孕措施直至注射VGR-R01后至少一年;
5.无严重的全身性疾病。